Tipos de Átomos: Isótopos
ISÓTOPO
Un mismo elemento químico puede estar constituido por diferenets átomos cuyos números atómicos (protones) son iguales, pero el número de neutrones es distinto. Estos átomos se denominan isótopos del elemento. Isótopos significa "mismo lugar", es decir, que como todos los isótopos de un elemento tienen el mismo número atómico, ocupan el mismo lugar en la Tabla Periódica.

- Si a un átomo se le añade un protón, se convierte en un nuevo elemento químico.
- Si a un átomo se le añade un neutrón, se convierte en un isótopo de ese elemento químico.
Los isótopos son átomos cuyos núcleos atómicos tienen el mismo número de protones pero diferente número de neutrones. No todos los átomos de un mismo elemento son idénticos y cada una de estas variedades corresponde a un isótopo diferente.
Cada isótopo de un mismo elemento tiene el mismo número atómico (Z) pero cada uno tiene un número másico diferente (A).
Por ejemplo. Se conocen 3 isótopos del elemento hidrógeno: el protio, el más abundante, con un protón y cero neutrones, el deuterio (D), cuyo núcleo alberga un protón y un neutrón y el tritio (T), cuyo núcleo contiene un protón y dos neutrones.
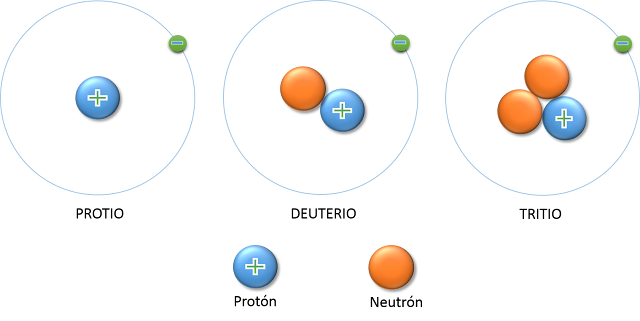
Los isótopos de un elemento tienen las mismas propiedades químicas pero difieren algo en sus propiedades físicas. Esta pequeña diferencia deriva de su distinta masa atómica.
Por ejemplo: el agua ligera, la común, pesa 18 Dalton; mientras que el agua pesada (contiene Deuterio) pesa 20 Dalton. Y su fórmula no deja de ser H2O.
Comentarios
Publicar un comentario