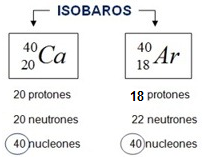
Tipos de Átomo: Isótonos
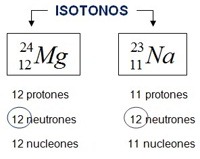
ISÓTONOS Dos átomos son isótonos cuando tienen el mismo número de neutrones, sin importar su número atómico (Z) o másico (A). Es decir, u n Isótono corresponde a aquellos átomos que presentan distinto número másico (suma de protones y neutrones), distinto numero atómico (protones), pero poseen igual número de NEUTRONES. Son átomos diferentes, por lo tanto, tienen diferente número atómico, también tienen diferente número másico, pero, tienen la misma cantidad de neutrones . El neutrones se puede hallar con la siguiente fórmula: N=A-Z Donde N es el número de neutrones, A es el número másico, Z es el número de protones